¿Cuál es el principio de Aufbau?
El principio de Aufbau dicta la manera en que los electrones se llenan en los orbitales atómicos de un átomo en su estado fundamental. Establece que los electrones se llenan en orbitales atómicos en el orden creciente del nivel de energía orbital. Según el principio de Aufbau, los orbitales atómicos disponibles con los niveles de energía más bajos se ocupan antes que aquellos con niveles de energía más altos.
La palabra “Aufbau” tiene raíces alemanas y se puede traducir aproximadamente como “construir” o “construir”. A continuación se proporciona un diagrama que ilustra el orden en que se llenan los orbitales atómicos. Aquí, “n” se refiere al número cuántico principal y “l” es el número cuántico azimutal.
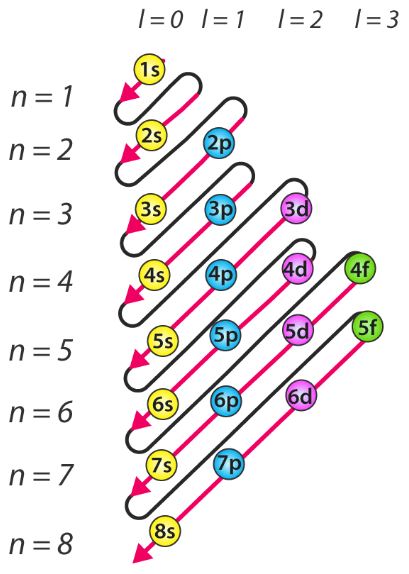
El principio de Aufbau se puede utilizar para comprender la ubicación de los electrones en un átomo y sus niveles de energía correspondientes. Por ejemplo, el carbono tiene 6 electrones y su configuración electrónica es 1s 2 2s 2 2p 2 .
Es importante tener en cuenta que cada orbital puede contener un máximo de dos electrones (según el principio de exclusión de Pauli ). Además, la manera en que los electrones se llenan en los orbitales en una sola subcapa debe seguir la regla de Hund , es decir, cada orbital en una subcapa dada debe estar ocupado individualmente por electrones antes de que dos electrones se emparejen en un orbital.
Características destacadas del principio de Aufbau
- Según el principio de Aufbau, los electrones primero ocupan esos orbitales cuya energía es la más baja. Esto implica que los electrones ingresan a los orbitales que tienen energías más altas solo cuando los orbitales con energías más bajas se han llenado por completo.
- El orden en que aumenta la energía de los orbitales se puede determinar con la ayuda de la regla (n + l), donde la suma de los números cuánticos principal y azimutal determina el nivel de energía del orbital.
- Los valores más bajos (n + l) corresponden a energías orbitales más bajas. Si dos orbitales comparten valores iguales (n + l), se dice que el orbital con el valor n más bajo tiene una energía más baja asociada.
- El orden en que los orbitales se llenan de electrones es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d , 7p, y así sucesivamente.
Excepciones
La configuración electrónica del cromo es [Ar] 3d 5 4s 1 y no [Ar] 3d 4 4s [19459008 ] 2 (como lo sugiere el principio de Aufbau). Esta excepción se atribuye a varios factores, como la mayor estabilidad proporcionada por las subcapas medio llenas y la brecha de energía relativamente baja entre las subcapas 3d y 4s.
La brecha de energía entre las diferentes subcapas se ilustra a continuación.

Las subcapas medio llenas presentan repulsiones electrón-electrón más bajas en los orbitales, lo que aumenta la estabilidad. Del mismo modo, las subcapas completamente llenas también aumentan la estabilidad del átomo. Por lo tanto, las configuraciones electrónicas de algunos átomos desobedecen el principio de Aufbau (dependiendo de la brecha de energía entre los orbitales).
Por ejemplo, el cobre es otra excepción a este principio con una configuración electrónica correspondiente a [Ar] 3d 10 4s 1 . Esto puede explicarse por la estabilidad proporcionada por una subshell 3D completamente llena.
Configuración electrónica utilizando el principio de Aufbau
Escribir la configuración electrónica de azufre
- El número atómico de azufre es 16, lo que implica que contiene un total de 16 electrones.
- Según el principio de Aufbau, dos de estos electrones están presentes en la subcapa 1s, ocho de ellos están en la subcapa 2s y 2p, y el resto se distribuye en las subcapas 3s y 3p.
- Por lo tanto, la configuración electrónica del azufre se puede escribir como 1s 2 2s 2 2p 2 3s 2 3p 4 .
Escribiendo la configuración electrónica de nitrógeno
- El elemento nitrógeno tiene 7 electrones (ya que su número atómico es 7).
- Los electrones se llenan en los orbitales 1s, 2s y 2p.
- La configuración electrónica del nitrógeno se puede escribir como 1s 2 2s 2 2p 3
Para obtener más información sobre el principio de Aufbau y otros conceptos relacionados (como la regla octeto ), regístrese en BYJU’S y descargue la aplicación móvil en su teléfono inteligente.