¿Qué es la serie de reactividad?
La serie de metales de reactividad, también conocida como la serie de actividad, se refiere a la disposición de los metales en el orden descendente de sus reactividades. Los datos proporcionados por la serie de reactividad se pueden usar para predecir si un metal puede desplazar a otro en una sola reacción de desplazamiento. También se puede utilizar para obtener información sobre la reactividad de los metales hacia el agua y los ácidos.
A continuación se proporciona un gráfico de la serie de reactividad de metales comunes.
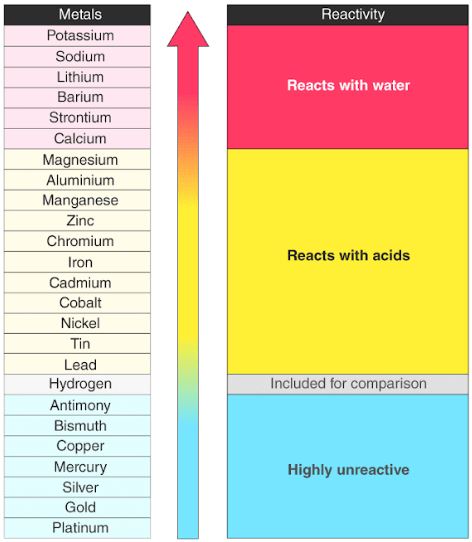
Los metales tienden a perder electrones fácilmente y forman cationes. La mayoría de ellos reaccionan con el oxígeno atmosférico para formar óxidos metálicos. Sin embargo, diferentes metales tienen diferentes reactividades hacia el oxígeno (los metales no reactivos como el oro y el platino no forman fácilmente óxidos cuando se exponen al aire).
Características destacadas
- Los metales en la parte superior de la serie de reactividad son potentes agentes reductores ya que se oxidan fácilmente. Estos metales se manchan / corroen muy fácilmente.
- La capacidad reductora de los metales se debilita mientras recorre la serie.
- La electropositividad de los elementos también se reduce al bajar la serie de reactividad de los metales.
- Todos los metales que se encuentran por encima del hidrógeno en la serie de actividades liberan gas H 2 al reaccionar con HCl diluido o H 2 SO 4 .
- Los metales que se colocan más arriba en la serie de reactividad tienen la capacidad de desplazar los metales que se colocan más abajo de sus soluciones salinas.
- Los metales de mayor clasificación requieren mayores cantidades de energía para su aislamiento de minerales y otros compuestos.
Otra característica importante de la serie de actividades es que, mientras viaja por la serie, la capacidad de donación de electrones de los metales se reduce.
Forma tabular larga de la serie Reactividad
Las reactividades de los metales se tabulan a continuación (en orden descendente) junto con sus iones correspondientes. Tenga en cuenta que los metales en Rojo reaccionan con agua fría, aquellos en Naranja no pueden reaccionar con agua fría pero pueden reaccionar con ácidos, y aquellos en Azul solo reaccionan con Algunos ácidos oxidantes fuertes.
| Serie de metales de reactividad | Iones formados |
| Cesio | Cs + |
| Francio | Fr + |
| Rubidio | Rb + |
| Potasio | K + |
| Sodio | Na + |
| Litio | Li + |
| Bario | Ba 2+ |
| Radio | Ra 2+ |
| Estroncio | Sr 2+ |
| Calcio | Ca 2+ |
| Magnesio | Mg 2+ |
| Berilio | Sé 2+ |
| Aluminio | Al 3+ |
| Titanio | Ti 4+ |
| Manganeso | Mn 2+ |
| Zinc | Zn 2+ |
| Cromo | Cr 3+ |
| Hierro | Fe 3+ |
| Cadmio | Cd 2+ |
| Cobalto | Co 2+ |
| Níquel | Ni 2+ |
| Estaño | Sn 2+ |
| Plomo | Pb 2+ |
| Hidrógeno | H + (No metálico, referencia para comparación) |
| Antimonio | Sb 3+ |
| Bismuto | Bi 3+ |
| Cobre | Cu 2+ |
| Tungsteno | W 3+ |
| Mercurio | Hg 2+ |
| Plata | Ag + |
| Platino | Pt 4+ |
| Oro | Au 3+ |
A pesar de no ser un metal, el hidrógeno a menudo se incluye en la serie de reactividad ya que ayuda a comparar las reactividades de los metales. Los metales colocados sobre el hidrógeno en la serie pueden desplazarlo de ácidos como HCl y H 2 SO 4 (ya que son más reactivos).
Usos importantes de la serie Reactividad
Además de proporcionar información sobre las propiedades y reactividades de los metales, la serie de reactividad tiene otras aplicaciones importantes. Por ejemplo, el resultado de las reacciones entre metales y agua, metales y ácidos, y las reacciones de desplazamiento único entre metales se pueden predecir con la ayuda de la serie de actividades.
Reacción entre metales y agua
El calcio y los metales que son más reactivos que el calcio en la serie de reactividad pueden reaccionar con agua fría para formar el hidróxido correspondiente mientras liberan hidrógeno gaseoso. Por ejemplo, la reacción entre el potasio y el agua produce hidróxido de potasio y gas H 2 , como se describe en la ecuación química proporcionada a continuación.
2K + 2H 2 O → 2KOH + H 2
Por lo tanto, la serie de reactividad de los metales se puede utilizar para predecir las reacciones entre metales y agua.
Reacción entre metales y ácidos
El plomo y los metales que están por encima del plomo en la serie de actividades forman sales cuando reaccionan con ácido clorhídrico o ácido sulfúrico. Estas reacciones también implican la liberación de gas hidrógeno. La reacción entre el zinc y el ácido sulfúrico es un ejemplo de tal reacción. Aquí, se forman sulfato de zinc y gas H 2 como productos. La ecuación química es:
Zn + H 2 SO 4 → ZnSO 4 + H 2
Por lo tanto, las reacciones entre metales y algunos ácidos se pueden predecir con la ayuda de la serie de reactividad.
Reacciones de desplazamiento único entre metales
Los iones de metales de bajo rango se reducen fácilmente por metales de alto rango en la serie de reactividad. Por lo tanto, los metales de bajo rango son fácilmente desplazados por metales de alto rango en las reacciones de desplazamiento único entre ellos.
Un gran ejemplo de tal reacción es el desplazamiento del cobre del sulfato de cobre por el zinc. La ecuación química para esta reacción viene dada por:
Zn (s) + CuSO 4 (aq) → ZnSO 4 (aq) + Cu (s)
Este concepto tiene varias aplicaciones prácticas en la extracción de metales. Por ejemplo, el titanio se extrae del tetracloruro de titanio mediante una reacción de desplazamiento único con magnesio. Por lo tanto, la serie de metales de reactividad también se puede utilizar para predecir el resultado de reacciones de desplazamiento único.
Para obtener más información sobre este concepto y otros conceptos relacionados, como la serie electroquímica , regístrese en BYJU’S y descargue la aplicación móvil en su teléfono inteligente.